Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

Considere as seguintes afirmações:
I. A primeira energia de ionização do átomo de Nitrogênio é menor que a primeira energia de ionização do átomo de Oxigênio.
II. O íon tem menor raio iônico que o .
III. A molécula apresenta geometria trigonal plana e é apolar.
IV. A molécula apresenta geometria bipirâmide trigonal e é polar.
Das afirmativas acima, está(ão) CORRETA(S)
apenas I e II.
apenas II e III.
apenas I e IV.
Apenas IV.
nenhuma.
I. Incorreta. Embora o oxigênio tenha um maior número atômico, o nitrogênio apresenta uma distribuição eletrônica de maior estabilidade, por conta dos elétrons desemparelhados no subnível 2p, conforme o esquema abaixo:
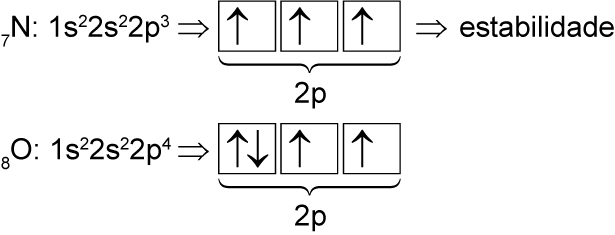
Por conta dessa estabilidade apresentada pelo nitrogênio, sua primeira energia de ionização é maior do que a do oxigênio.
II. Incorreta. Os íons e são isoeletrônicos – ambos com 36 elétrons. Entre espécies isoeletrônicas, a de maior raio é aquela com o menor número atômico (Z), em função da menor atração nuclear. Assim: R() > R().
III. Incorreta. A molécula é o metanal. De fato, apresenta geometria trigonal plana. No entanto, é uma molécula polar, uma vez que o vetor momento dipolar resultante da molécula é diferente do vetor nulo, conforme a figura:
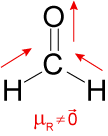
IV. Incorreta. A molécula de apresenta geometria bipirâmide trigonal, mas é uma molécula apolar, uma vez que o vetor momento dipolar resultante é o vetor nulo, conforme a figura a seguir:
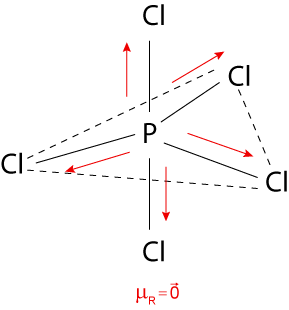
Gabarito da 1ª fase do Vestibular ITA 2026
Comentários + correções ao vivo | Poliedro ResolveInscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!